日前,我室汪显耀博士团队在国际期刊《Journal for ImmunoTherapy of Cancer》(中科院1区,IF:10.6)发表题为“Integrated system for screening tumor-specific TCRs, epitopes, and HLA subtypes using single-cell sequencing data”的文章。
近年来,单克隆抗体、双特异性抗体、抗体偶联药物和过继性细胞治疗等免疫靶向治疗极大地改变了恶性肿瘤的治疗格局。其中,嵌合抗原受体(CAR)T细胞疗法在血液系统恶性肿瘤中展现出尤为突出的前景,特别是在B细胞淋巴瘤治疗中取得了显著疗效,得益于靶向CD19、CD22等抗原的CAR-T疗法的成功。由于CAR-T细胞仅能识别细胞表面抗原,严重限制了其在实体瘤治疗中的应用。
与CAR不同,T细胞受体(TCR)能够识别由主要组织相容性复合体(MHC)呈递的8到11个氨基酸残基组成的抗原表位,这些表位可以源于细胞内蛋白。这一特性使得TCR疗法在靶向细胞内肿瘤抗原方面具有显著优势,从而克服了CAR-T疗法只能识别细胞表面抗原的关键局限。然而,目前已鉴定出的适用于免疫治疗的TCR数量仍然有限,而MHC限制性的存在大大减少了能够从TCR-T细胞疗法中获益的患者数量。因此,开发快速、高效且具成本效益的方法来筛选大量TCR库,并识别出能够靶向并杀伤肿瘤细胞的TCR,对于推进TCR-T免疫治疗至关重要。
通过搭建由NFAT-GFP报告细胞、新抗原呈递系统、高效率TCR组装组成的实验平台;利用HPV16阳性的宫颈癌患者样本公共单细胞测序数据库,根据肿瘤反应性T细胞基因表达特征挑选潜在的肿瘤反应性TCR,筛选靶向HPV16的肿瘤特异性TCR并鉴定其抗原表位。为宫颈癌免疫治疗提供新靶点,也为新抗原特异性TCR鉴定提供新思路。
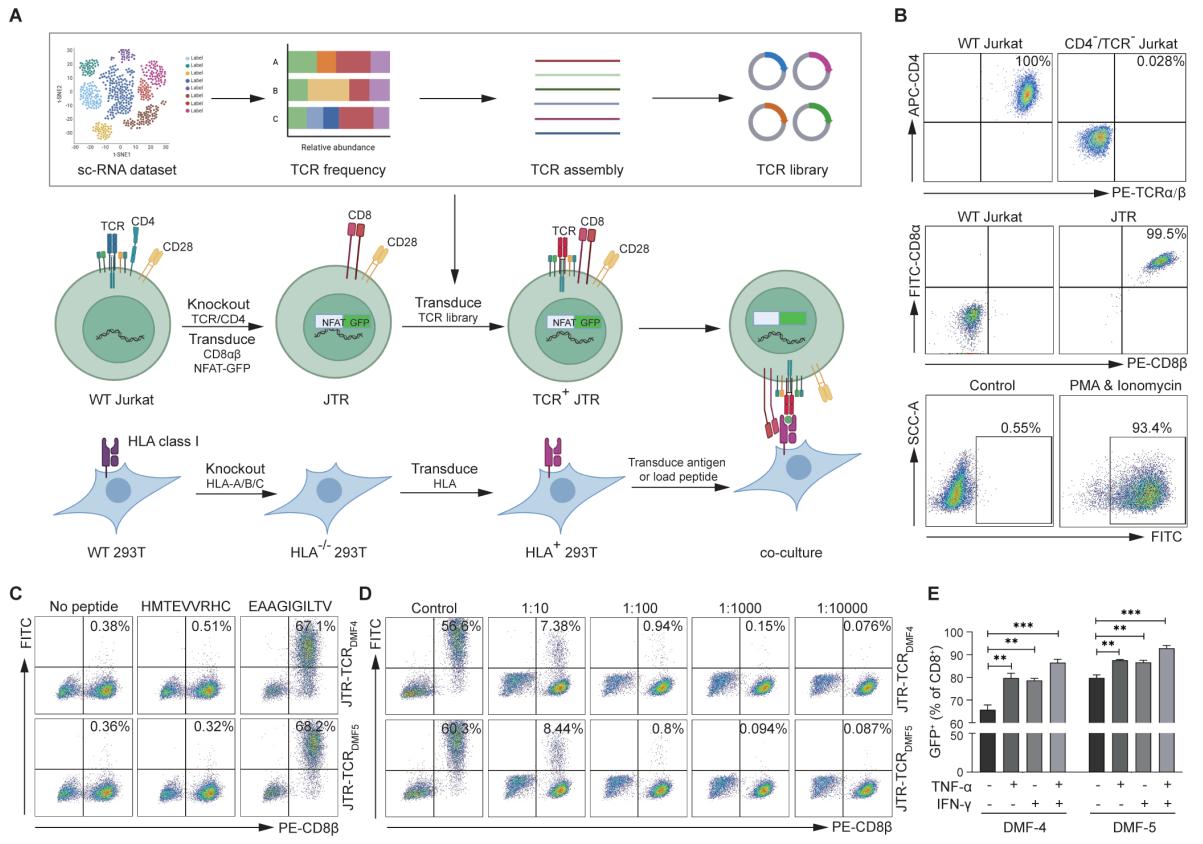
中国医学科学院苏州系统医学研究所张为国研究员为通讯作者,汪显耀博士为论文的共同第一作者。研究成果为肿瘤特异性TCR与抗原表位的高效识别提供了极具应用前景的策略,有望加速基于TCR的癌症免疫疗法的转化应用,为更多实体瘤患者带来新的治疗希望。(审核:一审覃明,二审韩勇,三审罗军敏,图文:汪显耀)
论文链接:https://doi.org/10.1136/jitc-2025-012029
